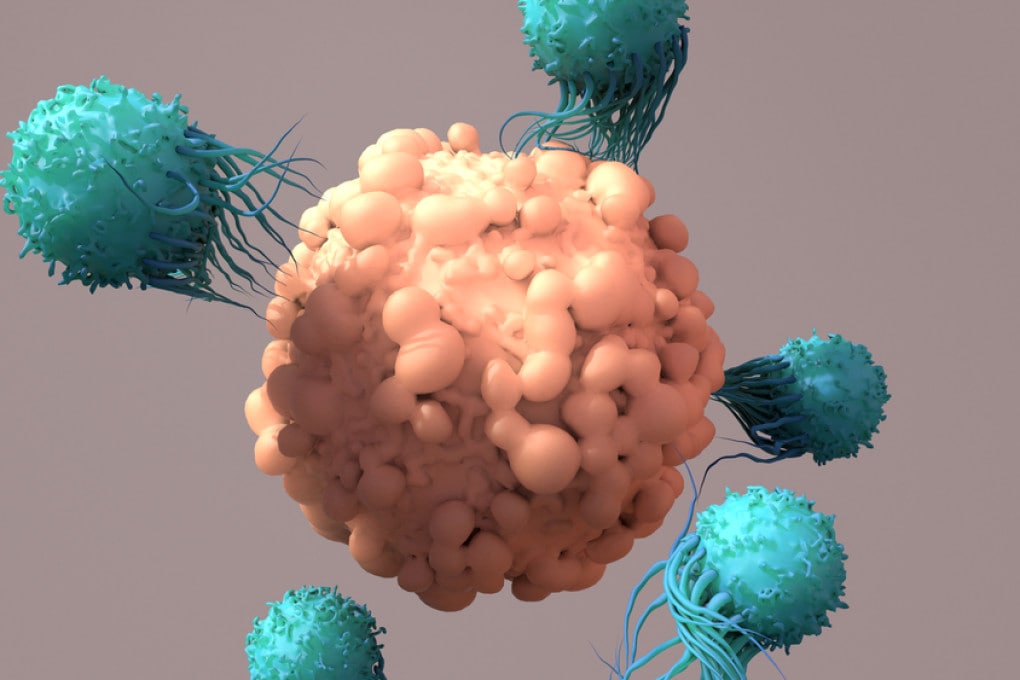
La possibilità di usare le cellule CAR-T anche nella terapia contro tumori solidi (e non solo per tumori del sangue) si fa ancora più concreta: questa forma rivoluzionaria di immunoterapia è stata usata con successo per estirpare alcune neoplasie nei topi.
Cellule immunitarie umane geneticamente modificate per potenziare l’attività anti-cancro sono infatti state dispiegate contro tumori fatti di cellule umane cresciuti nei topi, e sono state in grado di distruggerli.
Linfociti con i superpoteri. La capacità delle cellule cancerose di rendersi invisibili fa sì che il sistema immunitario spesso fatichi a riconoscerle e a prenderle di mira. Le CAR-T (la sigla sta per Chimeric Antigens Receptor Cells-T) sono linfociti T (i globuli bianchi che di norma riconoscono le minacce costituite da virus o cellule maligne, mantenendo la memoria degli attacchi subiti) ingegnerizzati in vitro per riconoscere e prendere di mira uno specifico antigene cellulare, come quelli espressi dalle cellule tumorali. Una volta modificate, queste cellule immunitarie vengono reinfuse nell’organismo del paziente, dove si comportano come esperti cecchini.
Potenzialità in espansione. Da ormai una decina di anni le CAR-T sono sfruttate nella pratica clinica: oggi offrono possibilità di cura ai pazienti con tumori del sangue come linfomi o leucemie, o del midollo (come il mieloma multiplo) che non rispondano alle cure iniziali o siano effetti da ricadute.
Da alcuni anni si studiano protocolli per utilizzare questa forma di immunoterapia anche contro i tumori solidi, cioè con massa compatta di tessuto, che non forniscono un microambiente favorevole all’azione delle CAR-T. Di recente, un gruppo dell’Ospedale Pediatrico Bambino Gesù di Roma guidato dal Professore Franco Locatelli è riuscito per la prima volta a impiegare le CAR-T nelle cura del neuroblastoma, un tumore solido molto aggressivo che si può manifestare in età pediatrica.
Correzioni più precise. Oltre a questo ostacolo nel bersaglio tumorale, ci sono altri due problemi: le CAR-T possono scatenare reazioni avverse molto importanti, e dover modificare le cellule di ogni singolo paziente che ne necessiti è un’operazione molto costosa. Stephen Hatfield, ricercatore della Northeastern University nel Massachusetts, ha affrontato queste difficoltà sfruttando un nuovo tipo di editing genetico, che permette di apportare più modifiche ai linfociti T ma con maggiore sicurezza.
Ha sfruttato l’editing di basi, una tecnica che permette di ridisporre gli atomi in una delle quattro “lettere” che compongono DNA e RNA, trasformandola in un’altra base senza alterare le combinazioni circostanti, per affinare il processo di modifica delle CAR-T senza fare troppi taglia alla doppia elica – un processo che rischia di favorire mutazioni indesiderate nel paziente.
Nessun tallone d’Achille. Ha così ottenuto CAR-T con sei modifiche, il numero più alto mai tentato prima (il precedente era di 4): tre correzioni volte a trasformare le cellule del donatore in cellule pronte all’uso, e altre tre introdotte apposta per permettere alle CAR-T di aggredire i tumori solidi. Le modifiche hanno messo fuori uso nelle CAR-T i recettori di due sostanze espresse dai tumori per sopprimere l’azione immunitaria, l’adenosina e la proteina PD-L1. Per rendere le CAR-T insensibili a un’altra proteina “silenziatrice” emessa dal tumore, il fattore di crescita trasformante beta (TGF-β), è stato necessario ricorrere a una tecnica di editing genetico tradizionale (che prevedeva il taglio della doppia elica) perché più efficace.
Risultati incoraggianti. Le cellule modificate sono state reinfuse in topi in cui i tumori solidi fatti di cellule umane erano stati lasciati crescere per un mese, fino a diventare, dice Hatfield, «ragionevolmente grandi, più grandi di molti dei tumori degli altri studi sulle CAR-T». Come si legge nello studio postato su biorXiv, in otto topi trattati con le cellule riprogrammate, i tumori si sono ridotti in dimensioni e sono scomparsi entro qualche settimana, mentre hanno continuato a crescere in quelli trattati con CAR-T senza le tre modifiche “chiave” o non trattati.
Inoltre, il sistema di editing usato ha permesso di ottenere CAR-T efficaci a dosi molto più basse rispetto alle solite terapie con questo tipo di cellule. Un vantaggio che potrebbe ridurre gli effetti collaterali e aumentare la sicurezza per i pazienti.
Ricerca e pazienza. Servirà comunque tempo prima di poter indagare la possibilità di usare questa specifica terapia in ambito clinico: il successo nei topi non garantisce gli stessi risultati negli esseri umani, perché il microambiente creato dai tumori solidi è molto diverso nel nostro organismo.